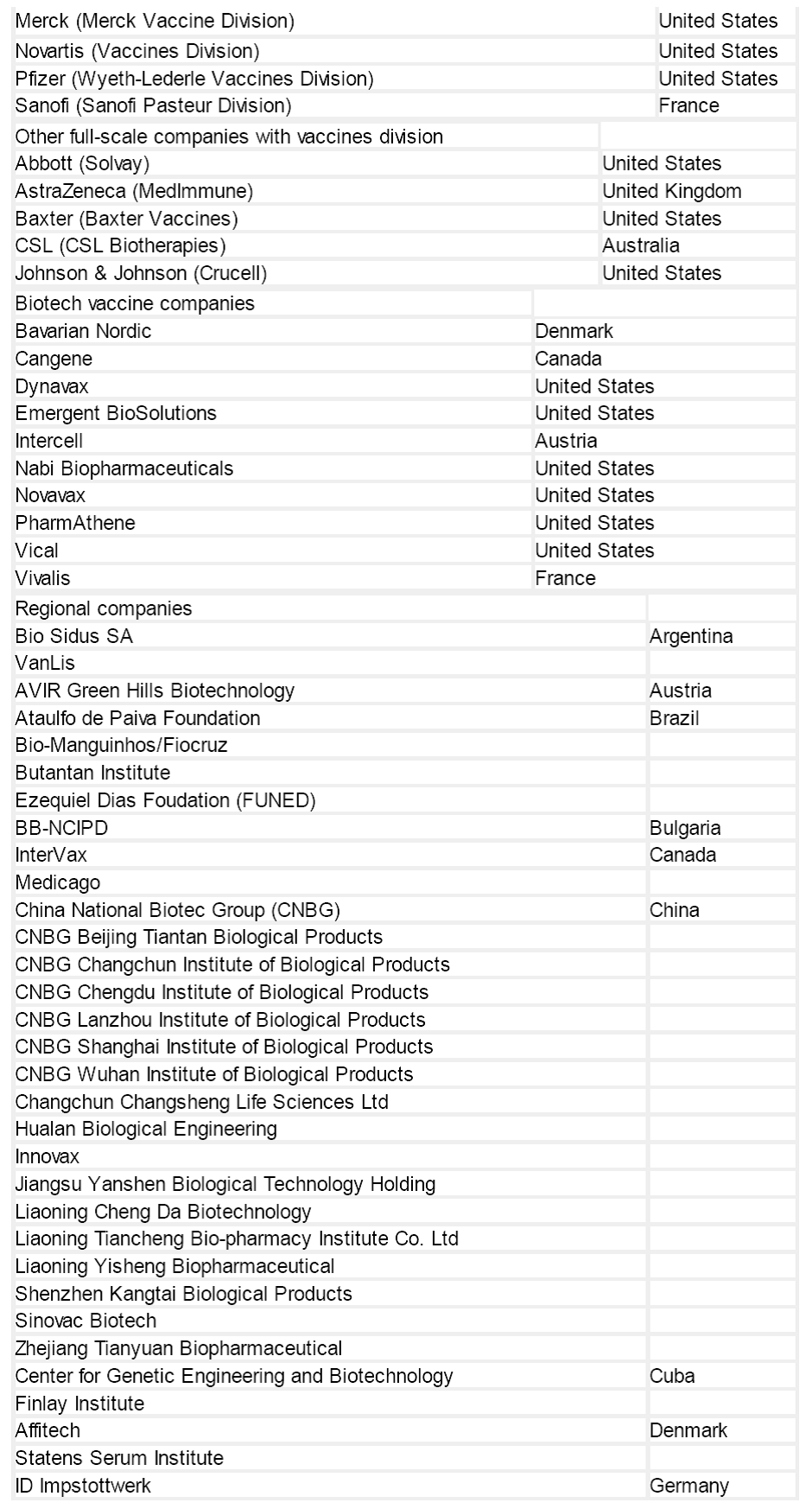
一 、疫苗接种简史
(一)早期进展:
人类尝试疫苗接种并不是从Edward Jenner 接种天花疫苗开始的。早在7 世纪,一些印度佛教徒就试图饮用蛇毒以产生免疫力,他们可能也诱导了抗毒素样的免疫反应。
16世纪,印度的婆罗门教徒定期接种人痘,即将天花脓包中的脓液干燥后接种人皮肤。
18世纪的文献记录了中国的天花疫苗接种。
19世纪70年代晚期,Louis Pasteur对鸡霍乱弧菌进行减毒的研究是自Jenner发表《天花疫苗》以来相关领域的第一个重大进展。
19世纪末,人类研制成功了伤寒,鼠疫和霍乱的灭活疫苗。
(二)20世纪上半叶
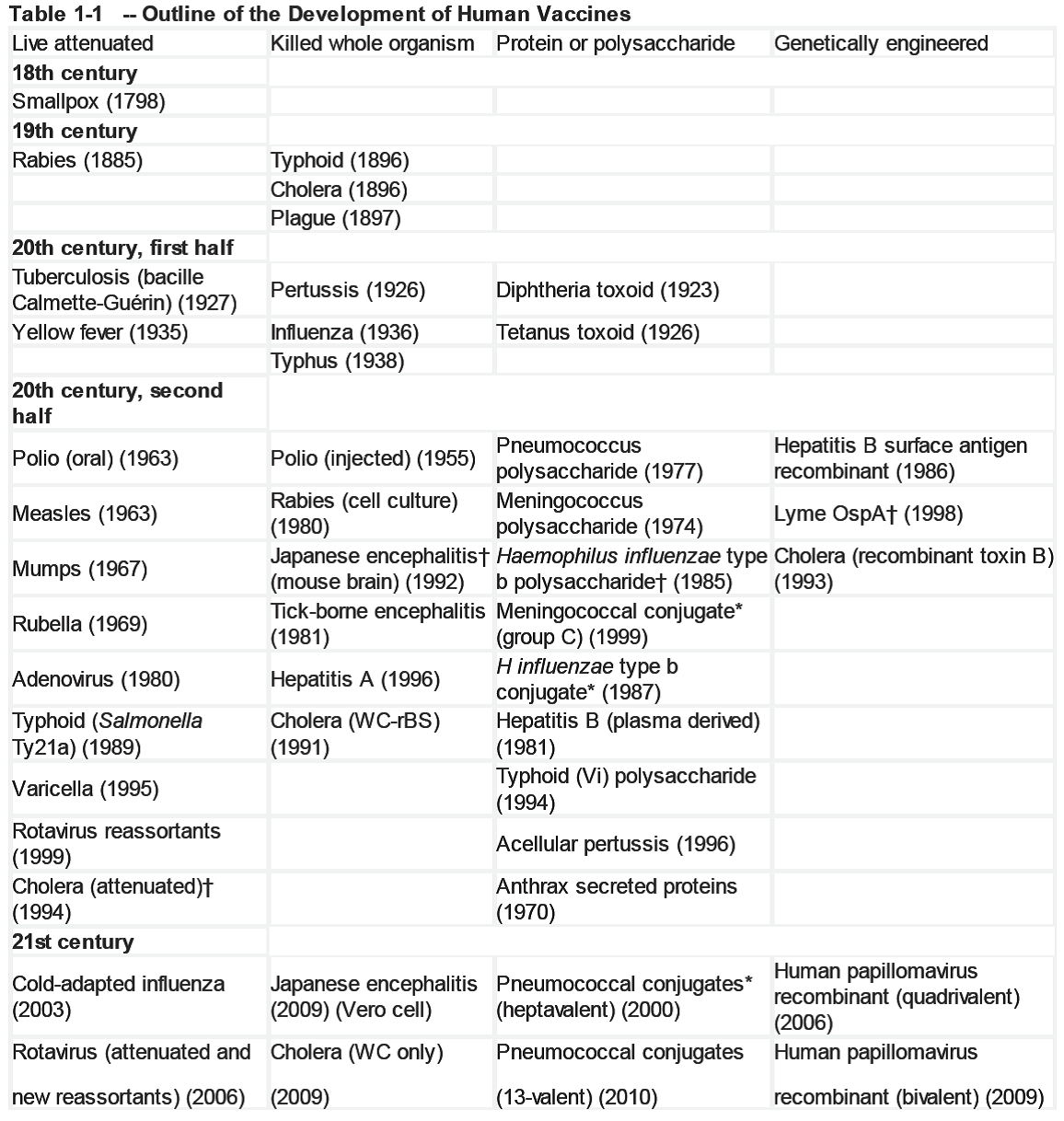
(三)20世纪下半叶
20世纪下半叶随着病毒能够通过细胞静置培养传代,疫苗的发展自1949年起开始进入黄金发展时代。曼彻斯大学的Hugh和 Mary maitland在1928年发明了细胞瓶组织培养技术,随后许多研究都致力于该方法的改进。 Maitland用含有鸡血清和矿物盐的培养基无菌培养切碎的鸡肾用以扩增牛痘病毒。Geoge gey通过连续滚动培养管增加细胞的通氧量从而提高了病毒产量。John enders、 Thomas weller和 Fred robbins于20世纪40年代末在波士顿儿童医院开展了细胞培养的研究。在使用了 Maitland的组织培养技术之后,他们决定尝试利用外植的人体细胞(来自出生后不久死亡的新生儿的皮肤和肌肉组织的成纤维细胞)进行病毒培养。第一次成功是在人单层细胞培养物上培养 LansingⅡ型脊髓灰质炎病毒。能够在体外单层细胞上以相对简单、安全的方式培养人类病毒,使得疫苗学迅猛发展,迄今势头未减。
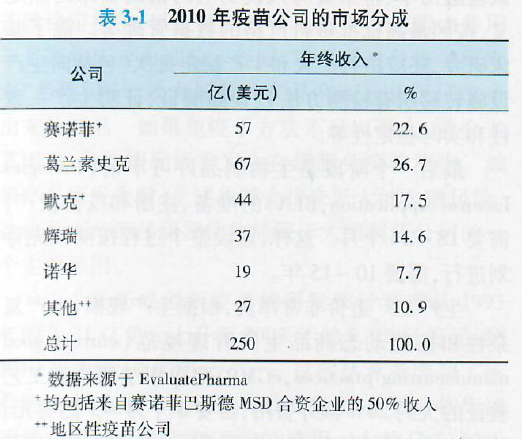
二、疫苗产业
疫苗产业由许多公司组成,主要包括从事疫苗的研究,开发,生产,销售和配送等任一环节。公司主要从产品销售和前景预测获得回报。疫苗产业规模较小但持续增长。2010年全球疫苗销售额估计超过250亿美元。虽然50多个国家都有疫苗企业,但大型疫苗公司主要位于美国和欧洲,根据销售收入,这些跨国公司占据了疫苗市场的主导地位,但根据疫苗产量,地区性公司的市场份额在逐年增加。
疫苗研发是个困难,复杂,高风险而且昂贵的,它包括临床研究,工艺开发和检定方法研究。疫苗研究高风险表现在大多数候选疫苗在临床前或临床早期就宣告失败。疫苗研发需要强有力的管理系统和质量控制以及科学家和工程师必不可少的技能。临床研发阶段包括按一定程序在人体中进行的疫苗安全性,免疫原性和有效性的研究。一般包括3个阶段:I期,对少量受试者进行早期的安全性和免疫原性研究。II期,在200-400名受试者中进行安全性,剂量范围和免疫原性研究。量范围和免疫原性研究。有时需要进行Ⅱb期试验,即非批准市的概念验证( proof-of- concept,PoC)研究(也就是在动物模型或人体上初步证实疫苗有效性);Ⅲ期,按许可标准进行的安全性和有效性试验。工艺开发涉及制造符合临床试验监管要求的试验用疫苗,包括多批用于临床试验、临床前毒理学研究和分析评估的疫苗。工艺开发还包括确定最终放大的生产工艺,并通常按1/10或全量的生产规模连续生产3批疫苗供临床免疫原性研究用。检定方法研究涉及建立全套能够检测原料纯度、疫苗产品稳定性和效力以及通过免疫学和其他标准预测疫苗效力的方法。是否继续研发的抉择要贯穿临床试验和工艺开发的每个阶段,并要以数据为依据。临床、生产工艺以及检定的研发工作要成为一个整体。
“工艺”可被笼统地分为2类:批生产和后处理。批生产包括细胞培养和(或)发酵以及后续的各种疫苗纯化步骤。后处理包括佐剂/防腐剂的加入、西林瓶或者注射器灌装(包括活病毒疫苗冻干)、贴签、包装和入库保藏等。工艺开发可能像临床试验一样花费昂贵,对于整个疫苗研发的成功是至关重要的。研发进入申报阶段后,随着临床研究规模扩大、生产规模放大和生产厂房建设,费用逐步增加。获批后疫苗的安全性和有效性研究(4期临床)也是很必要的 ,这需要大量的额外费用。需要重点指出的是,与药品不同,通常来说疫苗在通过了早期的人体临床概念验证研究后获得最终批准的可能性非常大。
临床研究比生物工艺开发更为直观,因为它直接决定了疫苗研发是否继续进行。这两个过程相互交织,每个过程都有限速步骤,因此必须协同一致。第一阶段涉及使疫苗通过临床Ⅱ期概念验证研究(在动物模型或人体初步验证有效性),需要花费两年或更长时间。首先需要候选疫苗被基础研究实验室认可,然后进行以下研发活动:制备临床I期样品的小量工艺和配方、疫苗签发的检定分析方法、临床前毒理学研究、评估临床反应的免疫学检测方法、新药研究申请、设计十合理的I/Ⅱa临床试验。第二步是在临床Ⅱb剂量研究开始之前确定产品和工艺,需要花费一年或更长时间。需要确定的内容包括合成/生物工艺步骤、组分数量和稳定性/配方等。稳定性、签发和原材料检定方法必须准备就绪。此外还必须建立支持剂量研究的免疫学和其他检测方法,以及撰写疫苗工艺和产品申请计划。第三步是确定临床剂量以及达到合适的生产规模,需要花费两年成更长时间。通常在中试车间完成临床级疫苗的生产、灌装和签发;在II 期临床试验中闸明疫苗的安全性和剂量反应;为3期临床确定关键的检测方法;批间一致性(按生产规模连续生产不善于3屁符合质量标准的疫苗产品的能力);完成向正式生产车间的技术转移,包括生产工艺和检定法。对于那不能用动物模型预测其在人体效果的疫苗,如人类免疫缺陷病毒(HIV )、疟疾和结核病疫苗,可进行小规模的II b 概念验证试验。这可为工艺开发、分析方法开发和工厂建设等重要资源的投入提供决策依据。
通常疫苗检定方法的研发是很困难的,因为大多数情况下疫苗被监管部门认为是不易界定的生物制品。疫苗签发检测最初采用功能性效力试验,如动物免疫原性检测等。近年来能够反映疫苗效力的更强大和精确的体外方法已被广泛接受。一般来说,生物学检测方法的不稳定性是实现工艺放大和生产一致性的主要障碍。
第四阶段是组织完成关键性的3期临床试验和批间一致性研究,需要36~48 个月。3 期临床试验成功的关键点包括根据发病率准确估算样本量、低试验退出率、将来要写入说明书的精确临床终点定义、按照最高标准进行严格的数据管理等。除了临床研究,还进行扩大和生产稳定批次( 包括向生产设施转移所有检测方法)、设施验证、证明生产一致性和实时稳性等。
最后一个阶段是生物制品许可申请( Biologics License Applieation,BLA )的准备、注册和疫苗投产,需要18~24 个月。这样,假设整个过程按照预先计划进行,需要10~ 15 年。
生产工厂造价非常昂贵,根据生产规模、生产复杂性和按照动态药品生产管理规范(current goodmanufacturing practices,cGMP) 要求用于清洁和工艺验证的大约20% 额外费用,需要5 千万~3 亿美元。除了少数例外,每种疫苗需要不同的生产厂房,这是因为各有不同的生产要求,不同产品的切换会造成管理上的困难。一些工艺过程是可放大的,像细菌或酵母发酵,因此扩大生产设备( 也就是发酵罐)的尺寸会在很大程度上提高产量,随着生产规模的扩大单位成本也会降低。其他生产工艺( 如用鸡胚和细胞培养生产病毒性疫苗)是不易放大的。为提高产量,就需要建造额外的工厂或者在现有工厂内建造额外的生产模块,因此随着生产规模的扩大单位成本不会明显降低。尽管疫苗批量生产非常复杂,疫苗投产3~5 年后大多数批量疫苗的全部成本下降到每剂10 美分以下,而且产品成本主要与灌发、封装和包装有关,对于生产厂家有限的成熟疫苗,能够在整个产品周期保持很高的利润空间。

生产工厂的建设需要提前进行( 在获批前4-6年),包括为了加速产品上市而建立产品库存所需要16 -12 个月。否则,从获批到上市之间会有1~5年的延迟期。
此外,最好能够在最终疫苗生产车间内生产出稳定批次,以此证明疫苗稳定生产的能力并用于3期临床效力试验。否则,需要通过免疫学研究来“桥连”用于效力试验的产品和商业化工厂生产来的产品。如果免疫学方法不足以强大,就会尤其困难,类似情况经常发生在细胞免疫检测中。如果产品研发失败,上述决策会带来巨大的金融风险,这也是疫苗产品研发往往局限于大型制药公司的一个主要原因。
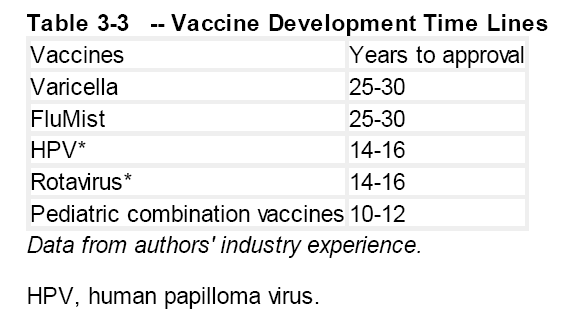
一个新药或者新疫苗的研发预计花费从1993年的2.31亿美元上升至2003 年的8.02 亿美元,到2010 年达到10 亿美元。这些估算考虑到了所有的成本,包括产品研发失败的费用、获批后临床试验的费用和改进生产工艺的费用。大约只有50%的费用是有形的,其余的是资金成本。然而这些数字是有争议的( 另有人估价为1亿~2 亿美元)。然而通过两种途径验证了较高的这一估价。第一,公司或业内每年报批的新疫苗数量很少,与每个新产品研发费用为6 亿~8 亿美元相关。如果一个公司每年花费1亿美元用来进行疫苗研发,那么预期每6~8年有一个新产品,这与事实基本相符。第二,生物技术公司专注于一个疫苗并将其成功投放市场花费的研发费用为5 亿~7 亿美元( Aviron/Medimmune)。总的来说,疫苗研发从概念到获批是一个漫长的过程,可用今年来皮中的几种疫苗的研发时间为例说明。
为了理解疫苗研发中产业所起的主导作用,必须了解疫苗研发公司与其合作伙伴之间的关系。疫苗研发合作网络中各合作伙伴的相对贡献如表3-4所示。
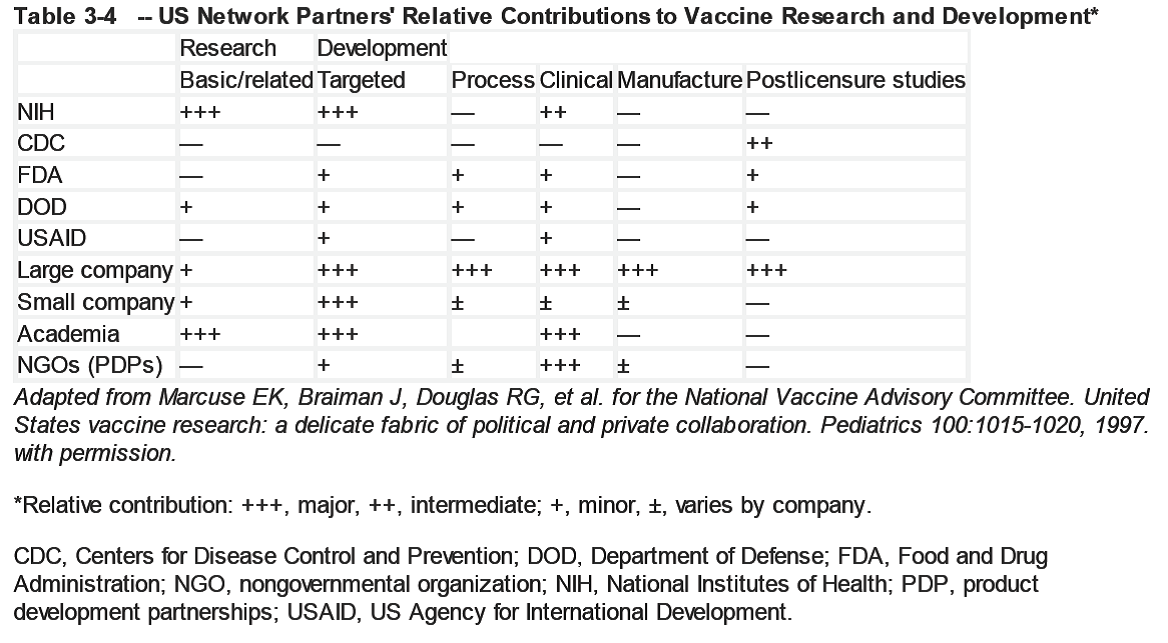
美国政府的几个机构在疫苗研发中扮演着重要角色。美国国立卫生研究院( NIH)是支持内部和外部(主要是学术单位)针对病原体( 如HIV )开展基础研究( 如基因疫苗和T 细胞记忆研究)的主要经费来源。这些研究有可能发现新的候选疫苗。通 过其疫苗临床试验网络,近年来NIH 在国内以及国际上临床开发领域的影响力得到了提高。此外,NIH 在1999 年成立了Dale and Betty Bumpers 疫苗研究中心,主要目的就是为了研发HIV 疫苗。
作为美国FDA 的一个部门,生物制品评价和研究中心(Center for Biologics Evaluation and Research,CBER) 主要负责新疫苗的审批。CBER 针对疫苗生产工艺、设施和各级临床试验制订了相应标准,用以确保获批疫苗的安全性和有效性。这些标准对疫苗研发的本质和方向以及疫苗研发的成本有着深远的影响。此外,CBER 内部保持着一个强大的研究基础,使它能够更好地评估各种研究的数据,同时它也是国际上最重要的疫苗监管机构。
美国疾病预防控制中心(CDC) 主导流行病学研究,确定疾病对公共卫生的影响等级,进行必要监测以确定危险因素。它在疫苗研发中最主要的作用是为疫苗研发确定公共卫生优先权,并且是负责安全性和有效性流行病学研究的主要政府机构。这些是对疫苗公司实施的IV期临床的补充。通过美国免疫实施咨询委员会( ACIP),CDC 推荐疫苗的使用,并且负责大多数疫苗的公共采购( 大约41% 直接通过儿童疫苗计划采购,大约16%间接通过联邦、州和地方政府采购,总计大约为美国儿童疫苗的57% )。这使得CDC 在决定疫苗需求和潜在利润方面具有重要作用。美国儿科学会和美国家庭医生学会等专业组织也为疫苗的使用提供建议,目前美联邦还没有针对成年人的疫苗计划,尽管国家医疗保险愿意为接种流感疫苗和肺炎结合疫苗付费,许多私人保险并不涵盖成年人的免疫接种。
美国国防部(Dep artment of Defense,DOD) 主导特定疫苗的研发,以保护美国官兵在部署至海外服兵役前免受传染病的侵扰。因此,DOD 对当前或将来行动地区的各种传染病威胁进行评估。如果私营机构不能提供疫苗,DOD 将主导这些疫苗的研究。由此产生的疫苗可能会惠及美国旅游者以及流行区域居民。除了进行疫苗研发之外,DOD 有生产小规模试验性疫苗的能力,但许多此类工作是与或大或小的公司合作完成的。最近通过的一项2001计划将会大幅提高DOD 的生产能力,该计划旨在建设一个政府所有、合同运营的疫苗生产设施。
Walter Reed 陆军研究所( Walter Reed Army In-stitute of Research,WRAIR )、美国军队传染病医学研究所( US Army Medical Research Institute for Infec-tious Diseases,USAMRID)、海军医学研究中心( Na-val Medical Research Center) 均为DOD 下属为军方提供基础和应用医学研究服务的机构。最近,为了建立应对生化恐怖威胁的医学应急对策,DOD 内部的一些部门与工业伙伴紧密合作。DOD 也开展针对疟疾和HIV 的重要研究。这种结盟为迅速启动医学措施以应对军方感兴趣的新病原奠定了必要基础。
隶属于健康和人类服务部的物医学高级研究与发展管理(BiomeialAdan ed ResearthandDelqpment Aauhoiy,BA RDA)成立于2006 年,用于促进应对紧急公共卫生事件的疫苗和其他相关物品的开发和采购。BARDA还负责生物盾牌计划(PojetBioshied ).用于对付可能遇到的生物或其他威胁。目前已经成功建立了针对天花、炭疽、肉毒毒素的医学应急措施。此外,BARDA 还为各种新型大流感疫苗的早期研发提供经费资助。BARDA实际上的作用是覆盖和填补NIH 资助的临床前或I期临床与处于2期或申报阶段的生物盾牌项目之间的空白。
美国国际开发署(U.s Agency for IntermationalDevelopment,USAID) 对那些可能对发展中国家5 岁以下儿童产生重大影响的疫苗研发提供有限的支持。
非政府组织的作用正在逐步加强。比尔和梅琳达盖茨基金会( Bill and Melinda Gates Foundation )向国际艾滋病疫苗行动组织( Intermational AIDS Vac-
cine Initiative)、疟疾疫苗行动组织( Malaria Vaccineative)和Aeras(致力于开发结核病疫苗)等多个组织提供了大量资金,用于研发那些可能对发展中国家产生重大影响的疫苗。此外,PATH(Programs for Approprivate Technology in Health) 也是一个非营利的相关组织,专门为发展中国家研发疫苗技术面打造私有组织之间的合作关系。这些产品研发合作伙伴组织( 实际上是非营利性生物技术公司)不但为其生物技术和大型制药合作伙伴带来了专业知识、动物模型、免疫检测方法和疫苗试验基地,还提供了降低科技风险、机会成本和金融风险的早期资本投资。此外,他们还提供验证新型疫苗技术和平台的机会。能够提供全方位服务的大型疫苗公司的主要作用是疫苗研发。他们的基础研究有限,但对特定生物的针对性研究较多,优势主要在临床和工艺开发方面。工艺开发和化学工程的技术和人员主要在这些公司,而无其他来源。符合FDA标准的临床试验几乎全部由这些大公司完成,而这些项目的早期研发往往由学术界和合同研究组织(contract research organizations,CROs )完成。这些大公司还具备临床研究、监管事务、数据管理、统计、项目管理以及其他所需学科的技术和人员。或许更重要的是,这些公司的管理是结构化的,能够迅速做出是否继续研发的决定。这是降低风险和评估有效疫苗开发所必需的。